- Auteur Alex Aldridge [email protected].
- Public 2023-12-17 13:38.
- Dernière modifié 2025-06-01 07:36.
La principale différence entre l'acide carbonique et le bicarbonate est que l'acide carbonique est un composé chimique neutre, tandis que le bicarbonate est un composé chimique chargé négativement.
L'acide carbonique est un acide faible qui se forme en solution lorsque le dioxyde de carbone se dissout dans l'eau, avec la formule chimique H2CO3. Le bicarbonate se forme par la combinaison de trois atomes d'oxygène, d'un atome d'hydrogène et d'un atome de carbone avec la formule chimique HCO3-.
Qu'est-ce que l'acide carbonique ?
L'acide carbonique est H2CO3. Parfois, nous donnons ce nom à des solutions contenant du dioxyde de carbone dissous dans de l'eau ou de l'eau gazeuse. C'est parce que l'eau gazeuse contient une petite quantité de H2CO3. De plus, l'acide carbonique est un acide faible et il peut former deux types de sels sous forme de carbonates et de bicarbonates. La masse molaire de ce composé est de 62,024 g/mol.
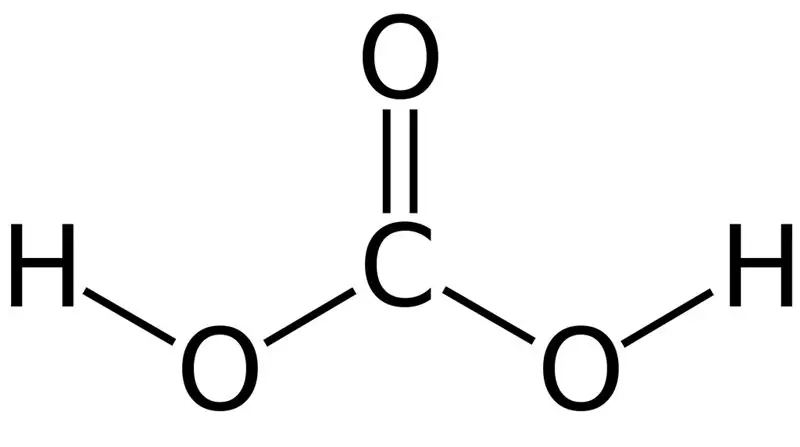
Figure 01: La structure chimique de l'acide carbonique
Lorsque le dioxyde de carbone se dissout dans l'eau, il entre dans un équilibre entre le dioxyde de carbone et l'acide carbonique. L'équilibre est le suivant:
CO2 + H2O ⟷ H2CO3
Si on ajoute un excès d'acide carbonique à une base, cela donne du bicarbonate. Mais, s'il y a un excès de base, alors l'acide carbonique tend à donner des sels carbonatés. Plus précisément, l'acide carbonique est un composé d'acide carboxylique qui a deux substituants de groupe hydroxyle attachés au carbone carbonyle. De plus, c'est un acide polyprotique, qui est capable de donner des protons. Il a deux protons amovibles, il est donc spécifiquement diprotique.
Qu'est-ce que le bicarbonate ?
Le bicarbonate se forme par la combinaison de trois atomes d'oxygène, d'un atome d'hydrogène et d'un atome de carbone. Le produit de cette combinaison peut être un ion ou un composé avec plus d'électrons que de protons. Nous pouvons le décrire comme une espèce chimique ayant la formule chimique HCO3-.
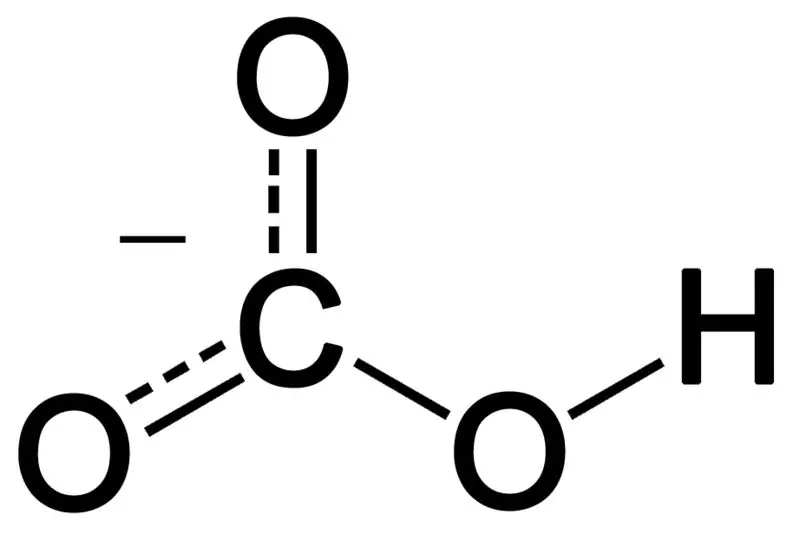
Figure 02: La structure chimique de l'anion bicarbonate
Ce composé est un élément crucial du système tampon du pH de l'organisme, en termes simples: il est responsable du maintien du sang dans un état qui n'est ni trop acide ni trop basique. De plus, il sert à contrôler les sucs digestifs une fois que l'estomac a fini de digérer les aliments. De plus, l'acide carbonique présent dans l'eau de pluie forme des ions bicarbonate lorsqu'il heurte les rochers. Ce flux d'ions bicarbonate est important pour maintenir le cycle du carbone.
Quelle est la différence entre l'acide carbonique et le bicarbonate ?
L'acide carbonique est un acide faible qui se forme en solution lorsque le dioxyde de carbone se dissout dans l'eau, et sa formule chimique est H2CO3. Le bicarbonate se forme par la combinaison de trois atomes d'oxygène, un atome d'hydrogène et un atome de carbone avec la formule chimique HCO3-. le différence clé entre l'acide carbonique et le bicarbonate est que l'acide carbonique est un composé chimique neutre, tandis que le bicarbonate est un composé chimique chargé négativement. De plus, l'acide carbonique est utilisé dans la fabrication de boissons pétillantes et gazeuses, le traitement des dermatites, dans les bains de bouche, etc., tandis que le bicarbonate est utilisé dans les préparations alimentaires telles que la cuisson (comme agent levant), et il donne la capacité de résister aux changements de pH.
L'infographie suivante résume la différence entre l'acide carbonique et le bicarbonate sous forme de tableau pour une comparaison côte à côte.
Résumé - Acide carbonique vs Bicarbonate
L'acide carbonique est H2CO3. Le bicarbonate se forme par la combinaison de trois atomes d'oxygène, un atome d'hydrogène et un atome de carbone, avec la formule chimique HCO3-. La principale différence entre l'acide carbonique et le bicarbonate est que l'acide carbonique est un composé chimique neutre, tandis que le bicarbonate est un composé chimique chargé négativement.






